¿Cuáles son las bases fuertes y débiles?
Una base fuerte es una base que se ioniza completamente en una solución acuosa. Una base débil es una base que se ioniza solo ligeramente en una solución acuosa. Una constante de ionización de base(Kb) es la constante de equilibrio para la ionización de una base.
¿Cuáles son las bases debiles y fuertes?
Ácidos y bases fuertes y débiles
Los ácidos fuertes y las bases fuertes se refieren a especies que se disocian completamente para formar los iones en solución. Por el contrario, los ácidos y bases débiles se ionizan solo parcialmente y la reacción de ionización es reversible.
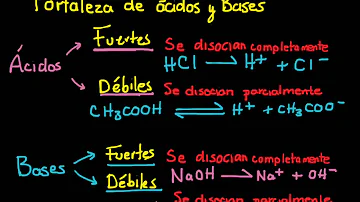
¿Qué es una base débil y 5 ejemplos?
Bases fuertes: hidróxido de sodio, hidróxido de litio, hidróxido de rubidio.
…
Ejemplos de bases débiles con su fórmula y constante de ionización básica K. b.
| Base débil | Fórmula | Constante de ionización |
|---|---|---|
| Etilamina | C2H5NH2 | 5,60 x 10-4 |
| Anilina | C6H5NH2 | 3,80 x 10-10 |
| Piridina | C5H5N | 1,70 x 10-9 |
| Benzilamina | C7H9N | 2,20 x 10-5 |
¿Cuáles son las bases debiles ejemplos?
Ejemplos
- Alanina.
- Amoniaco, NH3
- Metilamina, CH3 NH2
- Hidróxido de amonio, NH4 OH.
¿Cómo saber si es una base fuerte o débil?
Bases fuertes y débiles. El problema es similar con las bases: una base fuerte es una base que está 100% ionizada en solución . Si está menos del 100% ionizado en solución, es una base débil.
¿Qué es un base fuerte y ejemplos?
Una base fuerte es una base que se disocia completamente en una disolución acuosa. Un ejemplo de una base fuerte es el hidróxido de sodio, NaOH.
¿Cuál es base fuerte?
A strong base is something like sodium hydroxide or potassium hydroxide which is fully ionic. Puede pensar que el compuesto se divide al 100% en iones metálicos e iones de hidróxido en solución.
¿Es el agua una base débil?
El agua pura es tanto un ácido débil como una base débil . Por sí misma, el agua forma solo una cantidad muy pequeña de los iones H 3 O + y OH – que caracterizan las soluciones acuosas de ácidos y bases más fuertes.
¿Cuál es una base más fuerte?
El ion hidróxido es la base más fuerte que puede existir en solución.
¿Cuáles bases son fuertes?
Ejemplos de Bases Fuertes:
- NaOH, Hidróxido de sodio.
- LiOH, Hidróxido de litio.
- KOH, Hidróxido de potasio.
¿Cuáles son las bases más fuertes?
Ejemplos de Bases Fuertes:
Las siguientes sustancias son ejemplos de Bases Fuertes ya que en disolución acuosa se disocian completamente: NaOH Hidróxido de sodio. LiOH Hidróxido de litio. KOH Hidróxido de potasio.
¿Cuáles son 2 bases fuertes?
Algunas bases fuertes comunes de Arrhenius incluyen hidróxido de potasio (KOH), hidróxido de sodio (NaOH) , hidróxido de cesio (CsOH), hidróxido de estroncio (Sr(OH)2) e hidróxido de litio (LiOH).
¿Cuáles son las base fuerte?
En química, una base fuerte es aquella que no se disocia cuantitativamente en disolución acuosa, en condiciones de presión y temperatura constantes.
¿Cuál es la base débil?
Las bases débiles son las sustancias básicas que no se ionizan completamente en el agua . Un ejemplo de una base débil es el amoníaco. Cuando el NH 3 se disuelve en agua, una parte se disocia en catión de amonio y aniones de hidróxido al interactuar con las moléculas de agua.
¿Cuáles son 5 ejemplos de bases?
¿Cuáles son 5 ejemplos de bases? Algunas bases fuertes comunes de Arrhenius incluyen hidróxido de potasio (KOH), hidróxido de sodio (NaOH), hidróxido de cesio (CsOH), hidróxido de estroncio (Sr(OH)2) e hidróxido de litio (LiOH) .
¿Qué es una base fuerte ejemplos?
En química, una base fuerte es un tipo de electrolito de carácter fuerte (esto es, que se ioniza completamente en solución acuosa en condiciones de presión y temperatura constantes). fundamentalmente, es capaz de aceptar protones H+. Una reacción de este tipo viene dada por: para bases no hidroxílicas.
¿El amoníaco es base fuerte o base débil?
El amoníaco es una base débil típica. El amoníaco en sí mismo obviamente no contiene iones de hidróxido, pero reacciona con el agua para producir iones de amonio e iones de hidróxido. Sin embargo, la reacción es reversible y, en cualquier momento, alrededor del 99% del amoníaco todavía está presente como moléculas de amoníaco.
¿Cuál es el ejemplo de base fuerte?
Base fuerte: es un compuesto que tiene la capacidad de eliminar un protón de un ácido muy débil. O se disocian completamente en sus iones cuando están en agua. Los ejemplos son hidróxido de potasio (KOH), hidróxido de sodio (NaOH) .
¿Cuáles son los 7 ácidos fuertes?
Ácidos y bases
| ÁCIDOS FUERTES | FÓRMULA | BASES FUERTES |
|---|---|---|
| Ácido bromhídrico | HBr | Hidróxido de bario |
| Ácido clorhídrico | HCl | Hidróxido de calcio |
| Ácido nítrico | HNO3 | Hidróxido de potasio |
| Ácido perclórico | HClO4 | Hidróxido de sodio |
¿Cuáles son las bases fuertes y débiles, pon ejemplos?
Las bases fuertes son aquellas que se ionizan completamente en agua y producen una gran cantidad de iones de hidróxido. Las bases débiles son aquellas bases que se ionizan parcialmente en agua y producen una pequeña cantidad de iones de hidróxido. NaOH y KOH son bases fuertes. NH 4 OH, Ca(OH) 2 , Mg(OH) 2 are weak bases.
¿Qué son bases 4 ejemplos?
Algunos ejemplos de bases son: Soda cáustica o sosa cáustica (NaOH, hidróxido de sodio) Leche de magnesia (Mg(OH)2, hidróxido de magnesio) El cloro de piscina (NaClO, hipoclorito de sodio)
¿Cuál es la base más fuerte?
El anión metilo es la base más fuerte que se conoce actualmente, posición que ha ocupado durante los últimos 30 años.
¿Cómo se puede identificar una base?
Características de las bases
Poseen sabor amargo (jabonoso, como el cloro/lejía). Cambian el color del papel tornasol del rojo al azul. En disolución, son deslizantes al tacto. Reaccionan con los ácidos, produciendo agua y sal.
¿Cuántas bases fuertes hay?
Siempre es buena idea memorizar los 7 Ácidos Fuertes y las 8 Bases Fuertes que usamos en las clases de química.
¿Qué elementos son bases fuertes?
Ejemplos de Bases Fuertes: NaOH, Hidróxido de sodio. LiOH, Hidróxido de litio. KOH, Hidróxido de potasio.
¿Cuáles son los 7 acidos fuertes?
Ácidos y bases
| ÁCIDOS FUERTES | FÓRMULA | BASES FUERTES |
|---|---|---|
| Ácido bromhídrico | HBr | Hidróxido de bario |
| Ácido clorhídrico | HCl | Hidróxido de calcio |
| Ácido nítrico | HNO3 | Hidróxido de potasio |
| Ácido perclórico | HClO4 | Hidróxido de sodio |
